Y. Takenaka, I. Inoue, T. Nakano, M. Ikeda, Y. Kakinuma (2022)
FEBS J. 289: 1650-1667 DOI: 10.1111/febs.16249
(この論文はOxiORANGE、HYDROPとDAF-FM DAを使用しています)
N. Kurozumi, T. Tsujioka, M. Ouchida, K. Sakakibara, T. Nakahara, S. Suemori, M. Takeuchi, A. Kitanaka, M. Shibakura, K. Tohyama (2021)
Cancer Sci. 112: 3302–3313. DOI: 10.1111/cas.14982
(この論文はHPFとHYDROPを使用しています)
N. C. Luong, Y. Abiko, T. Shibata, K. Uchida, E. Warabi, M. Suzuki, T. Noguchi, A. Matsuzawa, Y. Kumagai (2020)
J. Toxicol. Sci. 45: 349-363 DOI: 10.2131/jts.45.349
K. Marunaka, M. Kobayashi, S. Shu, T. Matsunaga, A. Ikari (2019)
Int. J. Mol. Sci. 20: 3869 DOI: 10.3390/ijms20163869
K. Araki, K. Kawauchi, W. Sugimoto, D. Tsuda, H. Oda, R. Yoshida, K. Ohtani (2019)
Commun Biol. 2: 3 DOI: 10.1038/s42003-018-0246-9
(この論文はHPFとHYDROPを使用しています)
M. Abo, E. Weerapana (2019)
Antioxid. Redox Signal. 30: 1369-1386 DOI:10.1089/ars.2017.7408
K. Ueno, M. Urai, K. Izawa, Y.o Otani, N. Yanagihara, M. Kataoka, S. Takatsuka, M. Abe,
H. Hasegawa, K. Shimizu, T. Kitamura, J. Kitaura, Y. Miyazaki, Y.Kinjo (2018)
Sci Rep. 8: 17406, DOI: 10.1038/s41598-018-35699-4
K. Tomita, Y. Kuwahara, Y. Takashi, K. Igarashi, T. Nagasawa, H. Nabika, A. Kurimasa, M. Fukumoto, Y. Nishitani, T. Sato (2018)
Tumor Biol. 40:1010428318799250 DOI:10.1177/1010428318799250
T. Yamamoto, H. Nakano, K. Shiomi, K. Wanibuchi, H. Masui, T. Takahashi, Y. Urano, T. Kamata (2018)
Biol. Pharm. Bull. 41: 419-426 DOI:10.1248/bpb.b17-00804
K. Tomita, Y. Kuwahara, Y. Takashi, T. Tsukahara, A. Kurimasa, M. Fukumoto, Y. Nishitani, T. Sato (2017)
Biochem. Biophys. Res. Commun. 490: 330-335 DOI:10.1016/j.bbrc.2017.06.044
J. L. Kolanowski, A. Kaur, E. J. New (2016)
Antioxid. Redox Signal. 24: 713-730 DOI:10.1089/ars.2015.6588
H. Guo, H. Aleyasin, B. C. Dickinson, R. E. Haskew-Layton, R. R. Ratan (2014)
Cell Biosci. 4: 64 DOI:10.1186/2045-3701-4-64
M. Abo, Y. Urano, K. Hanaoka, T. Terai, T. Komatsu, T. Nagano (2011)
J. Am. Chem. Soc. 133: 10629-10637 DOI:10.1021/ja203521e
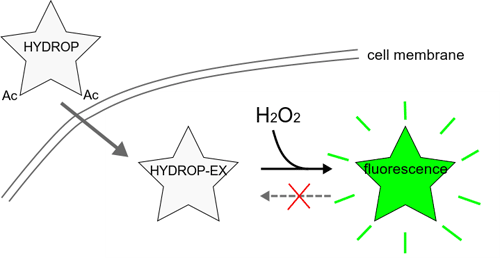
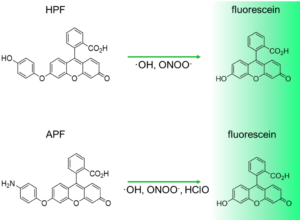
文献中の NBzFDA, NBzF はそれぞれ HYDROP, HYDROP-EX のことです。
![]()






 メールでのお問い合わせ
メールでのお問い合わせ
