AcidiFluor ORANGE-Zymosan A は、ファゴサイトーシスの検出によく用いられる Zymosan A を AcidiFluor ORANGE-NHS で標識した試薬です。PBS(-) で分散させて、貪食機能を有する細胞に投与するだけで観察が可能です。
AcidiFluor ORANGE-NHS の機能はそのままで高い pH 応答性を示します。
AcidiFluor™ Series
AcidiFluor™ ORANGE-Zymosan A
[酸性 pH 応答性プローブ]
570-590 nm:橙色
-
製品情報
AcidiFluor™ ORANGE-Zymosan A
製品情報印刷する
AcidiFluor ORANGE-NHS の物性
名称 検出対象 反応 pKa
Absmax (nm) FLmax (nm) ε Φ AcidiFluor ORANGE-NHS pH 可逆 5.3, 6.8 544 565 80,000 0.7 -
AcidiFluor ORANGE-NHS および AcidiFluor-ORANGE Zymosan A による細胞イメージング例
AcidiFluor™ ORANGE-Zymosan A
AcidiFluor ORANGE-NHS および AcidiFluor-ORANGE Zymosan A による細胞イメージング例印刷する
AcidiFluor ORANGE-NHS および AcidiFluor-ORANGE Zymosan A による細胞イメージング例
A431細胞 (EGFR過剰発現細胞株) による AcidiFluor ORANGE-NHS で標識した anti-EGFR 抗体の取り込み
anti-EGFR 抗体をAcidiFluor ORANGE-NHS と反応させ、限外ろ過により未反応色素の除去を行った。この AcidiFluor ORANGE 標識した anti-EGFR 抗体を、EGFR が過剰発現している細胞株である A431 細胞に添加し、共焦点顕微鏡にて経時的に観察を行った。抗体添加後 120 分で AcidiFluor ORANGE 由来の蛍光が検出され始め、180 分以降で高い蛍光強度が得られた。この手法により、AcidiFluor ORANGE 標識 anti-EGFR 抗体がエンドサイトーシスにより細胞に取り込まれ、酸性化する様子をとらえることができた。
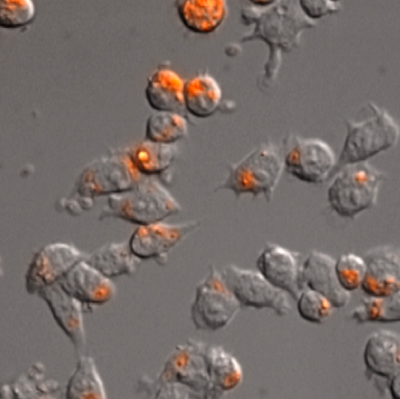
AcidiFluor ORANGE ZymosanA の RAW264.7 細胞による貪食撮影例
AcidiFluor ORANGE-ZymosanAを、RAW264.7細胞に添加し、蛍光顕微鏡にて経時的に観察を行った。AcidiFluor ORANGE-ZymosanA を取り込んだ細胞内で、蛍光強度の上昇が見られたことから、小胞の酸性化が示唆された。
-
AcidiFluor ORANGE-Zymosan A のフローサイトメーターでの使用例
AcidiFluor™ ORANGE-Zymosan A
AcidiFluor ORANGE-Zymosan A のフローサイトメーターでの使用例印刷する
AcidiFluor ORANGE-Zymosan A のフローサイトメーターでの使用例
概要
AcidiFluor ORANGE-Zymosan A は、免疫細胞の貪食作用を研究するためによく使用される Zymosan A を、酸性環境で蛍光が増強する AcidiFluor ORANGE で標識したものです。貪食されることによりファゴソーム中の酸性環境で強い蛍光を発するため、貪食作用の研究などに使われます。ここでは、マウスマクロファージ由来の RAW 264.7 細胞による貪食能をフローサイトメーターを用いて評価した結果と、類似色素との比較を示します。
RAW264.7 細胞のファゴサイトーシスの測定例
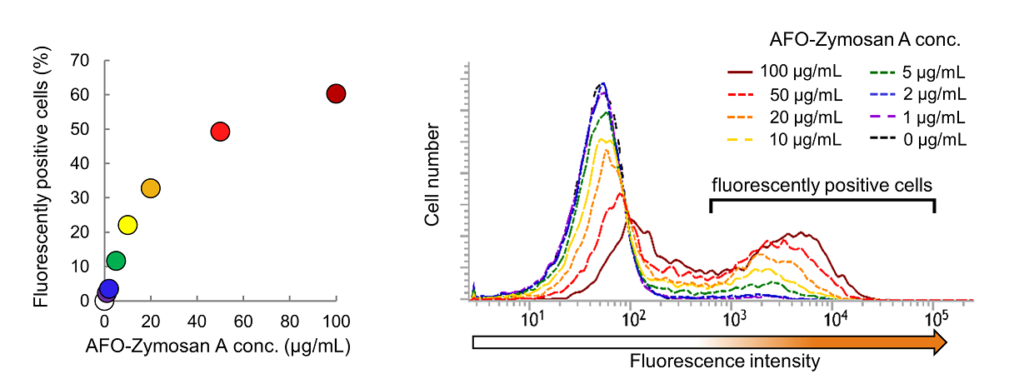
図1. AcidiFluor ORANGE-Zymosan A (AFO-ZymosanA) の投与量に応じた貪食細胞の割合の変化
同じ細胞数の RAW264.7 細胞に各濃度の AcidiFluor ORANGE-Zymosan A を加え、1時間培養して貪食させたのち、AFO の蛍光が観察される細胞数をフローサイトメーターで計測した。左図が結果のまとめ、右図は各条件におけるフローサイトメーターの測定結果で、横軸が AFO の蛍光強度、縦軸が細胞数を示す。図示したように、6×102 以上の蛍光強度を示す細胞を蛍光ポジティブ細胞と判定し、その割合を左図にプロットした。AFO の蛍光強度は、488 nm レーザーで励起し、586/42 nm (Phycoerythrin 用)フィルターを使用して測定した。計測プロトコル
- RAW264.7 細胞 7.5×104 個を 12 well plate に播種し、一晩培養した。
- 細胞培養培地に AcidiFluor ORANGE-Zymosan A を懸濁させて懸濁液を作成した。
- 2 を 2分間ソニケーションし、2 分間 4 ℃ で冷却した。この操作を 5 回繰り返し、トータル 10 分間のソニケーションにより AcidiFluor ORANGE-Zymosan A を分散させた。
- 培養容器より液体培地を除去し、希釈した AcidiFluor ORANGE-Zymosan A 懸濁液が終濃度 50 µg/mL となるように細胞に加え、37℃, 5% CO2 条件下で 1 時間インキュベート。
- 反応後の余分な AcidiFluor ORANGE-Zymosan A 懸濁液を培養容器から除去し、PBS で細胞を洗浄。
- Trypsin-EDTA 液を加え、細胞を培養容器から剥がした。
- 血清を含む細胞培養メディウムを添加し、トリプシンを中和。
- 遠心により細胞を沈殿させて上清を除き、細胞を PBS に懸濁。
- フローサイトメーターの詰まりを防ぐため、細胞懸濁液を 40 µm のセルストレイナーで濾過。
- フローサイトメーターで測定した。
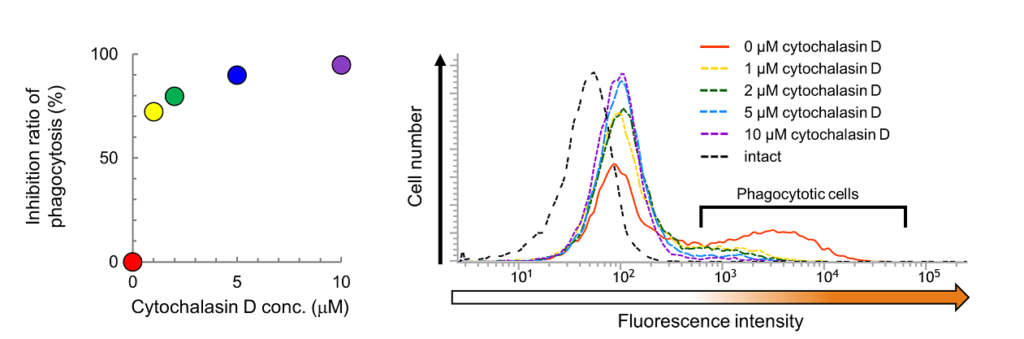
図2. 食作用阻害剤の効果
RAW264.7 細胞に各濃度の食作用阻害剤を添加して1時間培養後に、AcidiFluor ORANGE-Zymosan A が終濃度 50 µg/mL となるように加え1時間培養し、洗浄してフローサイトメーターによる測定を行った。食作用阻害剤として、サイトカラシンDを終濃度が 0 (赤), 1 (黄色), 2 (緑), 5 (青), 10 (紫) µg/mL となるように添加した。
左図が結果のまとめ、右図は各条件におけるフローサイトメーターの測定結果で、横軸が AFO の蛍光強度、縦軸が細胞数を示す。6 × 102 以上の蛍光強度を示す細胞を貪食細胞と判定した。各濃度の cytochalasin D における食作用阻害率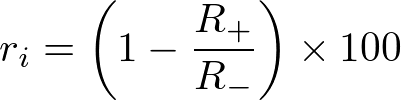
を計算した。ただし、R+ はサイトカラシンD処理での貪食細胞の割合、R– はサイトカラシンD未処理のときの貪食細胞の割合である。得られたサイトカラシンD の各濃度における食作用阻害率 72% (1 µM), 80% (2 µM), 90% (5 µM), 95% (10 µM) を左図にプロットした。
また、AFO の蛍光強度は、488 nm レーザーで励起し、586/42 nm (Phycoerythrin用)フィルターを使用して測定した。Negative control (未処理サンプル)は、破線(黒)で示している。これらのデータから、AcidiFluor ORANGE-Zymosan A の蛍光強度はマクロファージの貪食能をよく反映していると考えられる。
類似色素との比較
AcidiFluor ORANGE-Zymosan A は、類似の pH 感受性色素である pHrodo™ Red-Zymosan A と比べ蛍光強度が高く、陰性細胞と陽性細胞との区別が容易です。また、類似の pH 感受性色素である pHrodo™ Green-Zymosan A と同じ Zymosan A 濃度で比較すると、より高いシグナル強度が得られます。
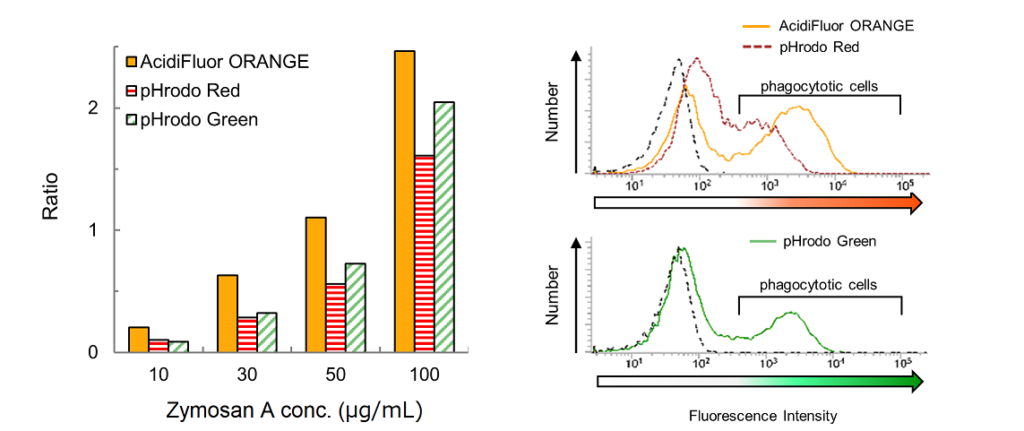
図3. 類似 pH 感受性色素である pHrodo Red-Zymosan A および pHrodo Green-Zymosan A との比較
RAW264.7 細胞に 10, 30, 50, 100 µg/mL の各色素で標識された Zymosan A を添加し、CO2 incubator 内で 1 時間反応後、PBS で洗浄してフローサイトメーターで測定した。得られた蛍光強度分布から貪食細胞 (phagocytotic cell) の数およびそれ以外 (unphagocytotic cell) を求め、比率を左図に示した。 右には、50 µg/mL のときの蛍光強度分布を例示。3×102 以上の蛍光強度を示す細胞を貪食細胞と判定した。Negative control (未処理サンプル)は破線(黒)で示した。
各色素は 488 nm レーザーで励起し、AcidiFluor ORANGE-Zymosan A および pHrodo Red-Zymosan A は 586/42 nm (Phycoerythrin 用)フィルターを使用、pHrodo Green-Zymosan A は 537/32 nm (FITC 用)フィルターを使用して測定した。図3に示すように、どの濃度においても AcidiFluor ORANGE-Zymosan A (図3左:橙)は、他製品に比べ貪食細胞検出率が高かった。また、図3右にあるように AcidiFluor ORANGE-Zymosan A (図3右上 実線: 橙)は、pHrodo Red-Zymosan A (図3右上点線:赤)に比べ、 貪食細胞と非貪食細胞のピークの分離がより明瞭である。
よくあるご質問
-
Q pH 3以下での蛍光強度は?A
-
Q 固定細胞に使えますか?A
基本的には固定細胞では使用できません。リソソームやエンドソームの酸性 pH は生きている細胞の活性によって酸性 pH が保たれており、固定により死んだ細胞ではその酸性が維持されなくなるためです。
ただし、リソソームに局在する AcidiFluor ORANGE、抗体などを標識した AcidiFluor-NHS や HaloTag に結合した HaloTag AcidiFluor ORANGE ligand の局在を知る目的で、固定後速やかに酸性 pH バッファーに置換して蛍光を確認することは可能と考えられます。
-
Q Q&A を見ても問題が解決しませんA
蛍光色素一般に関する Q&A も参照してください
参考文献
D. Asanuma, Y. Takaoka, S. Namiki, K. Takikawa, M. Kamiya, T. Nagano, Y. Urano, K. Hirose (2014)
Angew. Chem. Int. Ed. Engl. 53: 6085-6089 DOI:10.1002/anie.201402030
M. Isa, D. Asanuma, S. Namiki, K. Kumagai, H. Kojima, T. Okabe, T. Nagano, K. Hirose (2014)
ACS. Chem. Biol. 9: 2237-2241 DOI:10.1021/cb500654q
R. Watanabe, N. Soga, D. Fujita, K. V. Tabata, L. Yamauchi, S. H. Kim, D. Asanuma, M. Kamiya, Y. Urano, H. Suga, H. Noji (2014)
Nat. Commun. 5, Article number: 4519 DOI:10.1038/ncomms5519






 メールでのお問い合わせ
メールでのお問い合わせ
